Kamis, 30 April 2015
Intensitas Radiasi Benda Hitam
Radiasi benda hitam adalah radiasi elektromagnetik yang dipancarkan oleh sebuah benda hitam. Radiasi ini menjangkau seluruh daerah panjang gelombang. Distribusi energi pada daerah panjang gelombang ini memiliki ciri khusus, yaitu suatu nilai maksimum pada panjang gelombang tertentu. Letak nilai maksimum tergantung pada temperatur, yang akan bergeser ke arah panjang gelombang pendek seiring dengan meningkatnya temperatur.
Pada tahun 1879 seorang ahli fisika dari Austria, Josef Stefan melakukan eksperimen untuk mengetahui karakter universal dari radiasi benda hitam. Ia menemukan bahwa daya total per satuan luas yang dipancarkan pada semua frekuensi oleh suatu benda hitam panas (intensitas total) adalah sebanding dengan pangkat empat dari suhu mutlaknya. Sehingga dapat dirumuskan:
I total = σ . T4 ....................................................... (1)
dengan I menyatakan intensitas radiasi pada permukaan benda hitam pada semua frekuensi, T adalah suhu mutlak benda, dan σ adalah tetapan Stefan-Boltzman, yang bernilai 5,67 × 10-8 Wm-2K-4.
Untuk kasus benda panas yang bukan benda hitam, akan memenuhi hukum yang sama, hanya diberi tambahan koefisien emisivitas yang lebih kecil daripada 1 sehingga:
I total = e.σ.T4 ............................................................ (2)
Intensitas merupakan daya per satuan luas, maka persamaan (2) dapat ditulis sebagai:
P/A = = e. σ. T4 ...................................................... (3)
dengan:
P = daya radiasi (W)
A = luas permukaan benda (m2)
e = koefisien emisivitas
T = suhu mutlak (K)
Beberapa tahun kemudian, berdasarkan teori gelombang elektromagnetik cahaya, Ludwig Boltzmann (1844 - 1906) secara teoritis menurunkan hukum yang diungkapkan oleh Joseph Stefan (1853 - 1893) dari gabungan termodinamika dan persamaan-persamaan Maxwell. Oleh karena itu, persamaan (2) dikenal juga sebagai Hukum Stefan- Boltzmann, yang berbunyi:
“Jumlah energi yang dipancarkan per satuan permukaan sebuah benda hitam dalam satuan waktu akan berbanding lurus dengan pangkat empat temperatur termodinamikanya”.
Daya guna (Eksergi) dan Keadaan Mati
Dayaguna (Eksergi)
Apabila interaksi kalor terjadi antara sistem dan lingkungannya, kerja berguna maksimum yang dapat dilakukan oleh sistem menunjukkan dayaguna (eksergi) energy sistemnya. Kerja maksimum dilakukan hanya bila sistem mengalami proses reversible sebelum sistem akhirnya mencapai kesetimbngan dengan lingkungannya. Setelah kesetimbangan tercapai, sistem tidak dapat lagi membangkitkan kerja lebih lanjut, dan nilai dayagunanya menjadi nol.
Menurut hukumpertama, energy tidak dapat dimusnahkan selama proses, hanya dapat berubah bentuk dari satu ke lainnya. Sebaliknya oleh bertambahnya entropi (hokum ke dua termodinamika). Mjusnahnya dayaguna sebanding dengan meningkatknya entropi sistem dan lingkungan. Dayaguna yang dimusnahkan disebut energy tak berdayaguna.
Keadaan Mati
Jika keadaan materi dalam sistem tertutup yang berjumlah tertentu dan terpisah dari lingkungan, kesempatan terjadinya kerja menurun dan akhirnya hilang ketika sistem dan lingkungan mecapai kesetimbangan.
Sekali sistem dan lingkungan berada dalam kesetimbangan, tidak ada perubahan keadaan lebih lanjut dari sistem yang dapat terjadi secara spontan. Pada keadaan ini, sistem tidak dapat lagi membangkitkan kerja. Bila sebuah sistem dan lingkungannya ada dalam kesetimbangan satu sama lain, sistem dikatakan dalam keadaan mati. Misalkan keadaan berubah dari keadaan awal 1 ke keadaan akhir 0. Pada keadaan ini sistem berada dalam kesetimbangan termal dan mekanis dengan lingkungan. Kerja reversible maksimum yang dilakukan
Wrev = (-Qrev – ΔE) + (Qrev + T0 ΔS)
= - ΔE + T0 ΔS = - (E0-E)+ T0 (S0-S) (6-44)
= (E - T0S) – (E0 - T0 S0)
Perpindahan kerja berguna didefinisikan sebagai perpindahan kerja reversible maksimum dikurangi kerja dilakukan oleh atmosfer, dapat dituliskan sebagai
Wu = Wrev-Wlingk
Jika tekanan lingkungan adalah po, kerja yang dilakukan oleh atmosfer adalah
Wlingk= p0 (V0-V) = -p0(V -V0)
Sehingga kerja berguna Wu = Wrev - p0 ΔV (6-45)
Atau
Wu = Wrev - p0 dv/dt
Kerja berguna
Wrev,u = (E- T0S) = (E0 - T0 S0) - p0 (V0-V) (6-46)
Energi E mencakup energy kinetic, energy potensial, dan energy dalam dari sistem.
Sumber : Buku Termodinamika Penerbit Ainie Khuriati Riza Sulistiati Penerbit Graha Ilmu halaman 212
FLUIDA
Fluida adalah zat-zat yang mampu mengalir dan yang menyesuaikan diri dengan bentuk wadah tempatnya. Bila berada dalam keseimbangan, fluida tidak dapat menahan gaya tangensial atau gaya geser. Semua fluida memiliki suatu derajat kompresibilitas dan memberikan tahanan kecil terhadap perubahan bentuk.
Karena adanya kekentalan zat cair, maka terjadi perbedaan kecepatan partikel pada medan aliran.
Karena adanya kekentalan zat cair, maka terjadi perbedaan kecepatan partikel pada medan aliran.
Partikel zat cair yang berdampingan dengan dinding batas akan diam (kecepatan nol) sedang yang terletak pada suatu jarak tertentu dari dinding akan bergerak. Perubahan kecepatan tersebut merupakan fungsi jarak dari dinding batas.
Aliran viskos adalah aliran zat cair yang mempunyai kekentalan (viskositas). Kekentalan adalah sifat zat cair untuk melawan tegangan geser pada waktu bergerak/mengalir. Kekentalan disebabkan karena kohesi antara partikel zat cair.
Aliran viskos adalah aliran zat cair yang mempunyai kekentalan (viskositas). Kekentalan adalah sifat zat cair untuk melawan tegangan geser pada waktu bergerak/mengalir. Kekentalan disebabkan karena kohesi antara partikel zat cair.
Zat cair ideal tidak mempunyai kekentalan. Aliran viskos dapat dibedakan menjadi dua macam. Apabila pengaruh kekentalan (viskositas) adalah cukup dominan sehingga partikel-partikel zat cair bergerak secara teratur menurut lintasan lurus maka aliran disebut laminer. Aliran laminer terjadi apabila kekentalan besar dan kecepatan aliran kecil. Dengan berkurangnya pengaruh kekentalan atau bertambahnya kecepatan maka aliran akan berubah dari laminer manjadi turbulen. Pada aliran turbulen partikel-partikel zat cair bergerak secara tidak teratur (Triatmodjo, B., 1993).
Bila fluida diberi tegangan geser, maka ia akan mengalami perubahan bentuk, dengan kata lain ia mengalami regangan geser. Selain itu bagian yang terkena tegangan geser, langsung akan bergerak inilah yang disebut sebagai aliran. Jadi jelaslah bahwa zat padat tidak tergolong fluida, karena bila dikenai tegangan geser zat padat tidak akan mengalir (Sardjito, 2000).Osborne Reynolds berpendapat bahwa tipe aliran tergantung dari kecepatan, kerapatan dan kekentalan dari cairan dan ukuran dari tempat mengalirnya dan tergantung pula dari angka Reynolds (Kodoatie, J. R., 2001).
Kekentalan zat cair menyebabkan terbentuknya gaya-gaya geser antara dua elemen zat cair. Keberadaan kekentalan ini menyebabkan terjadinya kehilangan tenaga selama pengaliran atau diperlukannya energi untuk menjamin adanya pengaliran. Viskositas gas meningkat dengan suhu, tetapi viskositas cairan berkurang dengan naiknya suhu. Perbedaan dalam kecenderungan terhadap suhu tersebut dapat di terangkan dengan menyimak penyebab-penyebab viskositas. Tahanan suatu fluida terhadap tegangan geser tergantung pada kohesinya dan pada laju perpindahan momentum molekulnya.
Cairan dengan molekul-molekul yang jauh lebih rapat dari pada gas, mempunyai gaya-gaya kohesi yang jauh lebih besar dari pada gas. Kohesi nampaknya merupakan penyebab utama viskositas dalam cairan dan karena kohesi berkurang dengan naiknya suhu, maka demikian pula viskositas. Sebaliknya gas mempunyai gaya-gaya kohesi yang sangat kecil. Sebagian besar dari tahanannya terhadap tegangan geser merupakan akibat perpindahan momentum molekuler.
Tegangan molekular menimbulkan tegangan geser semu dalam gas, yang lebih penting dari pada gaya-gaya kohesi, dan karena kegiatan molekular meningkat dengan suhu, maka viskositas gas juga meningkat dengan suhu. Untuk tekanan-tekanan yang biasa viskositas tidak tergantung pada tekanan dan tergantung pada suhu saja. Untuk tekanan yang sangat besar, gas-gas dan kebanyakan cairan menunjukkan variasi viskositas yang tidak menentu terhadap tekanan.
Fluida dapat digolongkan ke dalam cairan atau gas. Perbedaan-perbedaan utama antara cairan dan gas adalah (a) cairan praktis tak kompresibel, sedangkan gas kompresibel dan sering kali harus diperlakukan demikian dan (b) cairan mengisi volume tertentu dan mempunyai permukaan-permukaan bebas sedangkan gas dengan massa tertentu mengembang sampai mengisi seluruh bagian wadah tempatnya.
Alat Ukur Aliran Menggunakan Venturi Meter
Telah sedikit kami singgung pada artikel sebelumnya bahwa venturi meter menjadi salah satu bentuk aplikasi penggunaan dari alat ukur tekanan. Lebih tepatnya, venturi meter adalah gabungan dari venturi effect dengan alat ukur tekanan. Venturi meter adalah salah satu bentuk alat ukur aliran yang dapat digunakan pada berbagai bidang.
Sebenarnya, alat atau instrumen untuk mengukur aliran fluida ada beberapa macam. Antara lain adalah Orifice Flow Meter, Flow Nozzle, Elbow Meter, Pitot Tube & Annubar, dan lain sebagainya. Namun pada kesempatan kali ini akan kita bahas alat ukur aliran fluida dengan menggunakan venturi meter.
Venturi Effect
(Source: wikipedia.org)
(Source: wikipedia.org)
Efek venturi terjadi pada sebuah aliran fluida yang mengalami kenaikan velocity seiring dengan penurunan luas penampang aliran, hal tersebut diiringi juga dengan terjadinya penurunan tekanan statis (static pressure) fluida tersebut. Hal tersebut sesuai dengan hukum aliran fluida dinamik, kecepatan aliran fluidaharus naik apabila terdapat restriksi pada pipa untuk memenuhi Hukum Kontinuitas, sedangkan besar tekanan harus turun untuk memenuhi Hukum Konservasi Mekanika Energi.
Menggunakan persamaan Bernoulli untuk kondisi khusus aliran fluidaincompressible, berikut adalah persamaan penurunan tekanan pada venturi meter:
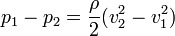
Dimana ρ adalah massa jenis fluida, v1 adalah kecepatan fluida yang lebih lambat, dan v2 adalah kecepatan fluida yang lebih tinggi. Persamaan ini hanya dapat digunakan pada aliran fluida yang tidak mampu mampat, dan tidak terjadi perubahan massa jenis.
Dalam sistem kontrol otomatis, melalui venturi meter didapatkan nilai tekanan di dua bagian venturi, yang selanjutnya dihubungkan dengan transmitter. Transmitter tersebut mengubah sinyal tekanan menjadi sinyal arus listrik, dan sistem kontrol data akan mengubah besaran arus yang ada tersebut menjadi besar aliran sesuai dengan standard yang sudah ditentukan.
Transmitter Venturi Flow
Gambar berikut adalah penggunaan Venturi Meter pada sebuah PLTU, untuk mengukur debit aliran udara panas yang akan masuk ke Pulverizer. Perhatikan tanda lingkaran merah dan biru, mereka adalah titik ambil sample tekanan statis dari aliran udara yang ada. Pada sistem ini, digunakan tiga titik sample pada sisi luas penampang kecil dan tiga juga di sisi luas penampang yang lebar. Sedangkan garis hijau adalah arah aliran udara di dalam venturi meter tersebut.
Aplikasi Venturi Meter
Korosi Pada Boiler
Korosi menjadi salah satu masalah yang sangat lazim terjadi pada boiler. Bahkan dapat dikatakan bahwa, tidak ada boiler yang tidak mengalami korosi. Karena boiler menggunakan media kerja air yang jika tidak diperhatikan, akan sangat mudah mengkorosi pipa-pipa boiler.
Air murni yang hanya tersusun oleh molekul H2O dan tanpa ada zat lain yang terlarut di dalamnya, bersifat tidak korosif. Zat-zat lain yang terlarut di dalam air lah yang menjadi salah satu pemicu air memiliki sifat yang korosif. Oksigen menjadi salah satu gas yang mudah larut di dalam air dan menjadi penyebab utama terjadinya korosi pada pipa-pipa boiler.
Temperatur air juga menjadi salah satu faktor pendukung terjadinya korosi. Seperti yang kita ketahui bersama bahwa air di dalam boiler akan mencapai temperatur yang sangat tinggi sesuai dengan jenis boiler yang digunakan. Air yang berada pada temperatur tinggi akan memiliki sifat-sifat yang sangat berbeda dengan air pada temperatur ruang. Pada temperatur di atas temperatur kritisnya, air akan menjadi lebih mudah melarutkan berbagai macam zat yang bahkan sebelumnya tidak mudah larut. Hal ini diakibatkan karena pada temperatur tersebut air lebih mudah terionisasi dan pecah membentuk ion-ion H3O+ dan OH-. Faktor inilah yang semakin mendorong terjadinya korosi pada pipa-pipa boiler.

Proses Terjadinya Korosi
(Sumber)
(Sumber)
Fe → Fe2+ + 2e-
O2 + 2H2O + 4e- → 4OH-
Selanjutnya ion Fe2+ bereaksi dengan ion OH- membentuk ferro hidroksida.
Fe2+ + 2OH- → Fe(OH)2
Pada kondisi kekurangan oksigen, atau biasa disebut dengan anaerobik, ferro hidroksida dapat teroksidasi lebih lanjut untuk membentuk lapisan magnetit yang justru bermanfaat bagi boiler untuk mencegah korosi yang lebih parah.
3Fe(OH)2 → Fe3O4 + H2 + H2O
Berikut adalah bentuk-bentuk korosi yang terjadi pada boiler:
- Penipisan Pipa. Korosi pertama pada boiler biasa terjadi pada pipa yang alirannya mengalami semacam tabrakan atau turbulen, seperti pada lekukan pipa. Kondisi ini menyebabkan molekul-molekul Fe hanya teroksidasi hingga membentuk Fe2+ dan tidak lebih lanjut membentuk Fe3+yang berfungsi untuk membentuk magnetit. Karena tidak terbentuk lapisan magnetit, maka korosi akan lebih dalam mengikis pipa boiler. Pengikisanpun terus berlanjut didukung dengan aliran fluida di dalam pipa yang turbulen, sehingga ketebalan pipa berangsur-angsur menipis akibat korosi jenis ini. Berikut adalah kondisi-kondisi yang memicu terjadinya korosi jenis ini:
- Aliran yang bertabrakan.
- Nilai pH yang rendah
- Kandungan oksigen di dalam air terlalu tinggi
- Adanya zat kimia yang memudahkan besi untuk lebih mudah terlarutkan
- Oxygen Pitting.
Korosi ini disebabkan oleh adanya kandungan oksigen yang berlebihan pada air boiler. Molekul oksigen akan terlokalisasi pada suatu titik tertentu dan mengoksidasi besi pipa pada titik tersebut. Hasil korosi yang ditimbulkan tidak tetap menempel pada area sebelumnya, akan tetapi molekul Fe(OH)2 akan terlarut ke dalam air dan meninggalkan jejak berupa lubang kecil (pitting) pada permukaan pipa. Jika kandungan oksigen terus berlebihan, maka akan semakin banyak lubang pitting yang ditimbulkan atau bahkan akan semakin memperdalam lubang yang sebelumnya sudah terbentuk. Oxygen Pitting Pada Pipa BoilerOxygen pitting biasa terjadi pada boiler kecil yang tidak terdapat fasilitas deaerasi untuk menghilangkan udara terlarut di dalam air. Boiler yang dalam kondisi tidak sedang beroperasi dan pipa-pipanya terisi oleh udara bebas, kemungkinan terjadinya oxygen pitting juga cukup besar.
Oxygen Pitting Pada Pipa BoilerOxygen pitting biasa terjadi pada boiler kecil yang tidak terdapat fasilitas deaerasi untuk menghilangkan udara terlarut di dalam air. Boiler yang dalam kondisi tidak sedang beroperasi dan pipa-pipanya terisi oleh udara bebas, kemungkinan terjadinya oxygen pitting juga cukup besar.
(Sumber)

Formasi Corrosion Fatigue
(Sumber)
(Sumber)

Proses Korosi Asam dan Dekarbonasi
(Sumber: B&W Steam, It’s Generation And Use)
(Sumber: B&W Steam, It’s Generation And Use)
Na2CO3 + H2 O → 2NaOH + CO2
Terbentuknya sodium hidroksida menyebabkan air bersifat basa. Air boiler yang telah bersifat basa tersebut dapat secara kapiler masuk ke sela-sela material pipa dan menimbulkan reaksi kimia antara sodium hidroksida dengan besi membentuk sodium ferit (Na2FeO4). Fenomena ini akan menyebabkan bagian-bagian pipa seperti lekukan, las-lasan, menjadi rapuh.
Mineral-mineral yang terlarut di dalam air boiler dapat menimbulkan korosi galvanik. Korosi galvanik adalah korosi yang diakibatkan oleh adanya perbedaan potensial elektroda antar logam. Adanya perbedaan potensial tersebut menjadi gaya yang mendorong ion-ion anoda dan katoda untuk saling bertukar posisi. Mineral-mineral yang umum terlarut di dalam air adalah kalsium dan magnesium. Keduanya jika larut ke dalam air akan membentuk ion-ion positif. Ion-ion mineral ini karena perbedaan nilai potensial elektrode alaminya dengan besi pipa boiler, akan bekerja sebagai katoda. Sedangkan ion-ion Fe2+ akan bekerja sebagai anoda. Korosi terjadi pada saat atom-atom Fe larut ke dalam air, sedangkan ion-ion mineral mengendap ke permukaan pipa boiler.
SIFAT-SIFAT TERMODINAMIK ZAT MURNI
Zat murni adalah zat yang mempunyai komposisi kimia yang tetap dan homogeny. Zat murni kebanyakan mengandung lebih dari satu fase, tetapi komposisi kimianya sama untuk semua fase. Misalnya, cairan air, campuran dari cairan air dan uap air, atau campuran dari padatan es dan cairan air adalah zat murni karena setiap fase mempunyai komposisi kimia sama. Namun, campuran udara cair dan udara gas bukan merupakan zat murni karena komposisi fase udara cair dan udara gas bukan merupakan zat murni karena komposisi fase udara cair berbeda dengan udara uap. Seringkali zat murni disebut zat yang dapat termampatkan sederhana.
ZAT MURNI (PURE SUBSTANCE) Merupakan zat yang mempunyai komposisi kimia yang tetap (stabil), misalnya : air (water) , nitrogen, helium, dan CO2. Zat murni bisa terdiri dari satu elemen kimia (N2 ) maupun campuran (udara).Campuran dari beberapa fase zat murni adalah zat murni, contohnya campuran air dan uap air. Tetapi campuran dari udara cair dan gas bukan zat murn karena susunan kimianya berubah atau berbeda.
FASE dari ZAT MURNI
Diidentifikasi berdasarkan susunan molekulnya.
• Solid (padat) : jarak antar molekul sangat dekat sehingga gaya tarik antar molekul sangat kuat, maka bentuknya tetap. Gaya tarik antara molekulmolekul cenderung untuk mempertahankannya pada jarak yang relatif konstan.Pada temperatur tinggi molekul melawan gaya antar molekul dan terpencar.
• Liquid (cair) : Susunan molekul mirip dengan zat padat , tetapi terhadap yang lain sudah tidak tetap lagi. Sekumpulan molekul akan mengambang satu sama lain.
• Gas : Jarak antar molekul berjauhan dan susunannya acak. Molekul bergerak secara acak.
PERUBAHAN FASA dari ZAT MURNI
Semua zat murni mempunyai mempunyai kelakuan umum yang sama. Sebagai contoh air (water).
State 1 : Pada state ini disebut compressed liquid atau subcooled liquid. Pada state ini penambahan panas hanya akan menaikkan temperatur tetapi belum menyebabkan terjadi penguapan (not about to vaporize).
State 2 : Disebut saturated liquid (cairan jenuh). Pada state ini fluida tepat akan berubah fasenya. Penambahan panas sedikit saja akan menyebabkan terjadi penguapan (about to vaporize). Akan mengalami sedikit penambahan volume.
State 3 : Disebut “Saturated liquid - vapor mixture” (campuran uap - cairan jenuh). Pada keadaan ini uap dan cairan jenuh berada dalam kesetimbangan. Penambahan panas tidak akan menaikkan temperatur tetapi hanya menambah jumlah penguapan.
State 4 : Campuran tepat berubah jadi uap seluruhnya, disebut “saturated vapor” (uap jenuh). Pada keadaan ini pengurangan panas akan menyebabkan terjadi pengembunan (“about to condense”).
State 5 : Disebut “superheated vapor” (uap panas lanjut). Penambahan panas akan menyebabkan kenaikkan suhu dan volume.
Kadang-kadang campuran gas seperti udara dianggap sebagai zat murni sepanjang tidak ada perubahan fase karena udara mempunyai beberapa karakteristik zat murni.
Salah satu alasan penting untuk memperkenalkan konsep zat murni adalah keadaan zat murni didefinisikan oleh dua sifat bebas. Sebagai contoh misalkan uap bermassa konstan berada dalam bejana yang dilengkapi peralatan sedemikian rupa sehingga tekanan, volume, dan suhunya dapat diukur dengan mudah. Jika volumenya kita tetapkan pada suatu harga suhu tertentu yang kita pilih, nilai tekanan tidak dapat diubah. Sekali kita sudah menetapkan harga volume dan suhu, harga tekanan dalam kesetimbangan diperoleh secara alami. Jadi di antara tiga koordinat termodinamik p, V dan T hanya dua yang merupakan sifat bebas.
Sistem yang keadaannya ditentukan oleh dua sifat bebas disebut sistem sederhana. Walaupun tidak ada sistem yang benar-benar sederhana namun banyak sistem yang dapat dimodelkan sebagai sistem sederhana untuk keperluan analisis termodinamika. Contoh sistem sederhana adalah sistem termampatkan sederhana. Zat murni merupakan zat yang digunakan dslam sistem termampatkan sederhana oleh karena itu zat murni seringkali disebut sebagai zat termampatkan sederhana.
Untuk lebih memahami istilah sifat bebas, kita tinjau keadaan cairan jenuh dan uap jenuh dari zat murni. Suhu dan tekanan cairan jenuh dan uap jenuh dari zat murni adalah sama, akan tetapi keadaan keduanya benar-benar tidak sama. Oleh karena itu kita katakana bahwa dalam keadaan jenuh, suhu dan tekanan bukan merupakan dua sifta yang saling bebas. Dua sifat bebas seperti tekanan dan volume jenis, atau tekanan dan kualitas digunakan untuk menentukan keadaan dari zat murni.
Sifat sistem, adalah cirri umum dari sistem yang mempunyai nilai. Nilai sifat ini seringkali dapat diukur secara langsung seperti tekanan p, volume V, dan suhu T. dalam termodinamika terdapat besaran yang bukan merupakan sifat sistem kerja dan kalor. Keduanya merupakan sesuatu yang diterapkan terhadap suatu sistem untuk menghasilkan berbagai perubahan sifat. Misalkan mula-mula sistem mempunyai suhu T1 kemudian suhunya dinaikkan menjadi T2. Pemanasan dapat dilakukan pada tekanan konstan, banyaknya kalor yang diperlukan adalah yang besarnya sangat bergantung pada lintasan integral Cp (T). Karena kalor bergantung pada lintasan, kalor bukanlah sifat sistem.
Sifat sistem digolongkan menjadi dua yaitu ekstensif dan intensif. Katakan terdapat suatu sistem yang dapat dibagi menjadi beberapa subsistem atau bagian. Jika harga sifat seluruh sistem sama dengan jumlah harga sifat subsistem atau bagian, sifat disebut ekstensif, besaran seperti volume total dan energi total adalah sifat ekstensif. Dan apabila harga sifat seluruh sistem tidak sama dengan jumlah harga sifat subsistem atau bagian, sifat ini disebut intensif. Besaran seperti suhu, tekanan dan rapat massa merupakan sifat intensif.
Sebarang besaran ekstensif apabila dibagi dengan massa atau jumlah mol menjadi besaran intensif. Pada umumnya persamaan termodinamika dinyatakan dalam besaran intensif karena persamaan menjadi tidak bergantung pada massa sistem. Perbandingan antara besaran ekstensif suatu sistem terhadap massa sistem disebut harga jenis rerata dari sistem. Besaran ekstensif dituliskan dengan huruf besar dan harga jenis dituliskan dengan huruf kecil.
Spesifikasi keadaan (state) dari sistem termodinamik bergantung pada sifat-sifat alami dari sistem seperti tekanan, suhu, volume dan masa.
contoh soal Suhu
1. Pada siang hari, suhu dalam sebuah kamar adalah 350 C. Berapa suhu itu, bila diukur dalam skala
Fahrenheit?
Penyelesaian:
Diketahui : tc = 35° C
Ditanya F = ..........?
Jawab
F = 5/9 xt°C+32
= 5/9 x35°+32
= 95°
2. Suhu sebuah ruangan yang menggunakan AC adalah 77°F
Berapa suhu itu, bila diukur daam satuan derajat celcius!
Penyelesaian:
Diketahui tf = 77° F
Ditanya C = ........?
Jawab :
C 5/9 x (tf - 32)
= 5/9 x (77-32)
= 5/9 x 45 = 25°C
3. Pada suhu berapakah skala yang sama antara Fahrenheit dan Celcius?
Penyelesaian:
Diketahui : F dan C
Ditanya : tf = tc
Jawab :
tc = 5/9 x (tc - 32)
tc = 5/9tc - 160/9
tc - 5/9tc = -160/9
(9tc—5tc)/9 = - 160/9
4tc/9 = -160/9 x 9
4tc = -160/9
tc = -160/9 = -40°
Jadi, pada skala -40° pada termometer Fahrenheit dan Celcius.
Fahrenheit?
Penyelesaian:
Diketahui : tc = 35° C
Ditanya F = ..........?
Jawab
F = 5/9 xt°C+32
= 5/9 x35°+32
= 95°
2. Suhu sebuah ruangan yang menggunakan AC adalah 77°F
Berapa suhu itu, bila diukur daam satuan derajat celcius!
Penyelesaian:
Diketahui tf = 77° F
Ditanya C = ........?
Jawab :
C 5/9 x (tf - 32)
= 5/9 x (77-32)
= 5/9 x 45 = 25°C
3. Pada suhu berapakah skala yang sama antara Fahrenheit dan Celcius?
Penyelesaian:
Diketahui : F dan C
Ditanya : tf = tc
Jawab :
tc = 5/9 x (tc - 32)
tc = 5/9tc - 160/9
tc - 5/9tc = -160/9
(9tc—5tc)/9 = - 160/9
4tc/9 = -160/9 x 9
4tc = -160/9
tc = -160/9 = -40°
Jadi, pada skala -40° pada termometer Fahrenheit dan Celcius.
Contoh Soal Kalor
1. Banyaknya kalor untuk menurunkan suhu 4 kg zat cair yang mempunyai kalor jenis 500 J/kg K dari 40 oC menjadi 20 oC adalah…
A. 20 kJ
B. 30 kJ
C. 40 kJ
D. 50 kJ
E. 60 kJ
Pembahasan :
Diketahui :
Massa (m) = 4 kg
Kalor jenis (c) = 500 J/kg K = 500 J/kg Co
Perubahan suhu (delta T) = 40 oC – 20 oC = 20 Co
Ditanya :
Kalor (Q)
Jawab :
Rumus Kalor :
Q = (m)(c)(delta T)
Q = (4)(500)(20) = 40.000 Joule = 40 kJ
kJ = kilo Joule
Jawaban yang benar adalah C.
2. Suatu benda padat yang massanya 2 kg dipanaskan dari suhu 30oC menjadi 100oC, memerlukan kalor sebanyak 7 × 105 Joule. Kalor jenis benda tersebut adalah …
A. 400 J/kg K
B. 500 J/kg K
C. 700 J/kg K
D. 1000 J/kg K
E. 5000 J/kg K
Pembahasan :
Diketahui :
Massa (m) = 2 kg
Kalor (Q) = 7 × 105 J = 700.000 J
Perubahan suhu (delta T) = 100 oC – 30 oC = 70 Co
Ditanya :
Kalor jenis (c) ?
Jawab :
c = Q / m T
c = 700.000 J / (2 kg)(70 Co) = 700.000 J / 140 kg Co
c = 5000 J/kg Co
c = 5000 J/kg K
Jawaban yang benar adalah E.
Diketahui :
]
Ditanya : kalor (Q)
Jawab :
Kalor yang diperlukan adalah :
Q = (1)(300)(10)
Q = 3000 Joule
m = 100 gram
c = 1 kal/gr°C
T1 = 20°C
T2 = 80°C
Kalor yang diperlukan:
Q = m x c x Δ T
Q = 100 x 1 x (80−20)
Q = 100 x 60
Q = 6000 kalori
B. 30 kJ
C. 40 kJ
D. 50 kJ
E. 60 kJ
Pembahasan :
Diketahui :
Massa (m) = 4 kg
Kalor jenis (c) = 500 J/kg K = 500 J/kg Co
Perubahan suhu (delta T) = 40 oC – 20 oC = 20 Co
Ditanya :
Kalor (Q)
Jawab :
Rumus Kalor :
Q = (m)(c)(delta T)
Q = (4)(500)(20) = 40.000 Joule = 40 kJ
kJ = kilo Joule
Jawaban yang benar adalah C.
2. Suatu benda padat yang massanya 2 kg dipanaskan dari suhu 30oC menjadi 100oC, memerlukan kalor sebanyak 7 × 105 Joule. Kalor jenis benda tersebut adalah …
A. 400 J/kg K
B. 500 J/kg K
C. 700 J/kg K
D. 1000 J/kg K
E. 5000 J/kg K
Pembahasan :
Diketahui :
Massa (m) = 2 kg
Kalor (Q) = 7 × 105 J = 700.000 J
Perubahan suhu (delta T) = 100 oC – 30 oC = 70 Co
Ditanya :
Kalor jenis (c) ?
Jawab :
c = Q / m T
c = 700.000 J / (2 kg)(70 Co) = 700.000 J / 140 kg Co
c = 5000 J/kg Co
c = 5000 J/kg K
Jawaban yang benar adalah E.
3. Kalor yang diperlukan untuk menaikan suhu 1 kg suatu zat cair yang mempunyai kalor jenis 300 J/Kg.K dari 20oC menjadi 30oC adalah….
PembahasanDiketahui :
]
Jawab :
rumus kalor
Kalor yang diperlukan adalah :
Q = (1)(300)(10)
Q = 3000 Joule
4. Zat cair yang massamya 2 kg dipanaskan dari suhu 20oC menjadi 80oC, memerlukan panas sebesar 6 × 105 Joule. Kalor jenis zat cair tersebut adalah…
Pembahasan
Diketahui :
Pembahasan
Diketahui :
Ditanya : Kalor jenis zat (c)
Jawab :
Rumus kalor jenis :
Jawab :
Rumus kalor jenis :
Kalor jenis zat adalah :
c = 600.000 / (2)(60) = 600.000 / 120
c = 5000 J/Kg. K
c = 600.000 / (2)(60) = 600.000 / 120
c = 5000 J/Kg. K
5. Air bermassa 100 gram berada pada suhu 20° C dipanasi hingga suhu 80° C. Jika kalor jenis air adalah 1 kal/gr ° C tentukan jumlah kalor yang diperlukan, nyatakan dalam satuan kalori ?
pembahasan :
m = 100 gram
c = 1 kal/gr°C
T1 = 20°C
T2 = 80°C
Kalor yang diperlukan:
Q = m x c x Δ T
Q = 100 x 1 x (80−20)
Q = 100 x 60
Q = 6000 kalori
Langganan:
Postingan (Atom)









