Joseph Black (16 April 1728 - 6 Desember 1799) adalah seorang dokter dan ahli kimia Skotlandia, yang dikenal untuk penemuannya panas laten, panas spesifik, dan karbon dioksida. Dia adalah profesor Kedokteran di University of Glasgow (di mana ia juga menjabat sebagai dosen di Kimia).
James Watt, yang ditunjuk sebagai pembuat instrumen filosofis di universitas yang sama pada 1775, berkonsultasi dengan Black pada percobaan dengan mesin uap skala kecil. Watt dan Black juga bekerja sama dalam sebuah proyek untuk memproduksi natrium hidroksida,. Namun, Black tidak diketahui memiliki kepentingan bisnis dalam proses, yang tidak menikmati sukses komersial bangunan kimia di kedua Universitas Edinburgh dan Universitas Glasgow diberi nama setelah Hitam.
Awal Tahun
Joseph Black lahir di Bordeaux, Perancis, di mana ayahnya, yang berasal dari Belfast, Irlandia, terlibat dalam perdagangan anggur. Ibunya berasal dari Aberdeenshire, Skotlandia, dan keluarganya juga dalam bisnis anggur.Ia masuk Universitas Glasgow ketika dia berusia delapan belas tahun, dan empat tahun kemudian ia pergi ke Edinburgh untuk belajar medis lebih lanjut.
Keseimbangan Analitis
Pada sekitar tahun 1750, Joseph Black mengembangkan keseimbangan analitis berdasarkan pada balok ringan seimbang pada titik tumpu berbentuk baji. Setiap lengan membawa panci di mana sampel atau bobot standar ditempatkan. Ini jauh melebihi keakuratan saldo lain waktu dan menjadi instrumen ilmiah penting di sebagian besar laboratorium kimia.
Pada 1757, ia diangkat sebagai Profesor Regius Praktek Kedokteran di University of Glasgow.
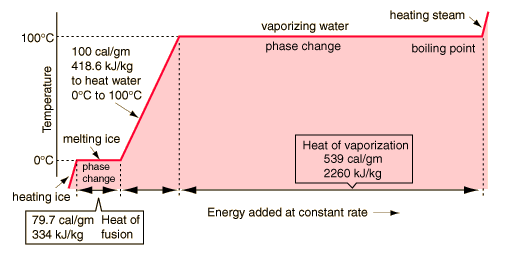
Panas Laten
Pada 1761 Black menyimpulkan bahwa penerapan panas ke es pada titik leleh tidak menyebabkan kenaikan temperatur dari campuran es / air, melainkan peningkatan jumlah air dalam campuran. Selain itu, Black mengamati bahwa penerapan panas ke air mendidih tidak mengakibatkan kenaikan suhu campuran air/uap, melainkan peningkatan jumlah uap. Dari pengamatan tersebut, ia menyimpulkan bahwa panas yang diterapkan harus dikombinasikan dengan partikel es dan air mendidih dan menjadi laten. Teori panas laten menandai awal termodinamika.Black teori panas laten adalah salah satu nya kontribusi ilmiah yang lebih penting, dan satu di mana ketenaran ilmiahnya terutama bersandar. Ia juga menunjukkan bahwa zat-zat yang berbeda memiliki spesifik yang berbeda memanas.
Ini semua terbukti penting tidak hanya dalam perkembangan ilmu pengetahuan abstrak tetapi dalam pengembangan mesin uap.Panas laten air sangat besar dibandingkan dengan banyak cairan lainnya, sehingga memberikan dorongan untuk upaya sukses James Watt untuk meningkatkan efisiensi mesin uap ditemukan oleh Thomas Newcomen. Watt menambahkan kondensor terpisah, dan terus silinder pada suhu uap (dengan melampirkan dalam jaket uap penuh) sehingga menyimpan sejumlah besar energi dalam menghindari pemanasan silinder pada setiap siklus mesin.
Karbondioksida
Black juga menjelajahi sifat dari gas yang diproduksi dalam berbagai reaksi. Dia menemukan bahwa batu kapur (kalsium karbonat) dapat dibakar atau diberikan asam dan menghasilkan gas yang dia namakan "udara tetap".Dia mengamati bahwa udara tetap lebih padat daripada udara dan tidak mendukung baik nyala atau kehidupan binatang. Black juga menemukan bahwa ketika ditiupkan melalui larutan kapur (kalsium hidroksida), itu akan memicu kalsium karbonat. Dia menggunakan fenomena ini untuk mengilustrasikan bahwa karbon dioksida dihasilkan dari pernapasan hewan dan fermentasi mikroba.
Kehidupan Pribadi
Pada tahun 1757 atau 1758 Hitam menjadi teman dari James Watt, yang pertama kali memulai studinya pada tenaga uap di Universitas Glasgow pada 1761. Dia memberikan pembiayaan yang signifikan dan dukungan lainnya untuk penelitian awal Watt pada mesin uap. Black juga adalah anggota dari Poker dan terkait dengan David Hume, Adam Smith, dan sastrawan dari Pencerahan Skotlandia. Hitam tidak pernah menikah. Dia meninggal di Edinburgh pada usia 71, dan dimakamkan di sana di Greyfriars Kirkyard. Pada tahun 2011 peralatan ilmiah diyakini milik Hitam ditemukan selama penggalian arkeologi di University of Edinburgh.
Asas Black
Asas Black adalah suatu prinsip dalam termodinamika yang dikemukakan oleh Joseph Black.Bunyi Asas Black adalah sebagai berikut:
"Pada pencampuran dua zat, banyaknya kalor yang dilepas zat yang suhunya lebih tinggi sama dengan banyaknya kalor yang diterima zat yang suhunya lebih rendah" Asas ini menjabarkan:
-Jika dua buah benda yang berbeda yang suhunya dicampurkan, benda yang panas memberi kalor pada benda yang dingin sehingga suhu akhirnya sama.
-Jumlah kalor yang diserap benda dingin sama dengan jumlah kalor yang dilepas benda panas.
-Benda yang didinginkan melepas kalor yang sama besar dengan kalor yang diserap bila dipanaskan.
dengan banyaknya kalor yang diterima zat yang suhunya lebih rendah"
Rumus Asas Black
Secara umum rumus Asas Black adalah :
Qlepas = Qterima
keterangan :
-Qlepas adalah jumlah kalor yang dilepas oleh zat
-Qterima adalah jumlah kalor yang diterima oleh zat
dan rumus berikut adalah penjabaran dari rumus diatas :
(M1 X C1) (T1-Ta) = (M2 X C2) (Ta-T2)
Keterangan :
M1 = Massa benda yang mempunyai tingkat temperatur lebih tinggi
C1 = Kalor jenis benda yang mempunyai tingkat temperatur lebih tinggi
T1 = Temperatur benda yang mempunyai tingkat temperatur lebih tinggi
Ta = Temperatur akhir pencampuran kedua benda
M2 = Massa benda yang mempunyai tingkat temperatur lebih rendah
C2 = Kalor jenis benda yang mempunyai tingkat temperatur lebih rendah
T2 = Temperatur benda yang mempunyai tingkat temperatur lebih rendah.
Catatan : Pada pencampuran antara dua zat, sesungguhnya terdapat kalor yang hilang ke lingkungan sekitar. Misalnya, wadah pencampuran akan menyerap kalor sebesar hasil kali antara massa, kalor jenis dan kenaikan suhu wadah.